摘要
早产儿视网膜病变(ROP)是新生儿致盲性眼病,早期筛查和定期随访可以预防该病导致严重视功能损害,被世界卫生组织归类为新生儿可避免盲的防治目标。自2004年中华人民共和国国家卫生健康委员会颁发《早产儿治疗用氧和视网膜病变防治指南》以来,中华医学会眼科学分会眼底病学组积极推动ROP的筛查和治疗,于2014年更新了《中国早产儿视网膜病变筛查指南》。经过近二十年的努力,我国5期ROP病变基本消失。为了合理掌握ROP分类标准及药物治疗的适应证,中华医学会眼科学分会眼底病学组、中国医师协会眼科医师分会眼底病专委会组织相关领域专家通过认真、全面、充分讨论达成共识性意见,参考国际标准术语更新了我国ROP的分类和新名词术语的中文译名,并补充制定抗血管内皮生长因子药物治疗适应证的标准,以供临床医师在临床实践中参考应用。
正文
早产儿视网膜病变(ROP)是新生儿致盲性眼病,早期筛查和定期随访可以预防该病导致严重视功能损害,被世界卫生组织归类为新生儿可避免盲的防治目标。中华医学会眼科学分会眼底病学组于2004年参与制定了中华人民共和国国家卫生健康委员会颁发的《早产儿治疗用氧和视网膜病变防治指南》[1],积极推动了我国早产儿的救治和ROP的筛查,有效降低了我国严重ROP的发生率。随后,针对我国不同地区新生儿重症监护水平发展不平衡以及ROP发生率总体下降缓慢的问题,中华医学会眼科学分会眼底病学组与新生儿重症监测科专家组共同商讨,决定更新指南,强化防范意识,于2014年更新了《中国早产儿视网膜病变筛查指南》[2]。近年来,随着麻醉下新生儿眼底照相机和荧光素眼底血管造影(FFA)的不断发展与更新,眼科医师对视网膜新生血管病变的认识也更加精准;同时,抗血管内皮生长因子(VEGF)药物因其能有效控制视网膜新生血管,已成功用于ROP活动期的治疗,基本替代了激光光凝和冷冻治疗[3]。经过近二十年的努力,我国ROP 5期病变基本消失。为了合理掌握ROP分类标准及药物治疗的适应证,中华医学会眼科学分会眼底病学组、中国医师协会眼科医师分会眼底病专委会组织相关领域专家通过认真、全面、充分讨论达成共识性意见,在保留《中国早产儿视网膜病变筛查指南(2014年)》筛查标准的基础上,采纳ROP相关名词的国际标准术语,并参考《早产儿视网膜病变国际分类(第3版)》[4]更新了我国ROP的分类和新名词术语的中文译名,并补充制定抗VEGF药物治疗适应证的标准,以供临床医师在临床实践中参考应用。
PART 01ROP分类和更新1.1
ROP分区和新的补充
病灶分区:和前2版指南相同,病变按发生部位分为3个区(图1)。Ⅰ区:以视盘中央为中心,视盘中央到黄斑中心凹距离的2倍为半径画圆;Ⅱ区:以视盘中央为中心,视盘中央到鼻侧锯齿缘为半径画圆,去除Ⅰ区之后的环状区域;Ⅲ区:除Ⅰ区、Ⅱ区以外剩余的部位为Ⅲ区。疾病范围按时钟位的位置标注。早期病变越靠近后极部(Ⅰ区),病变进展的风险越大。
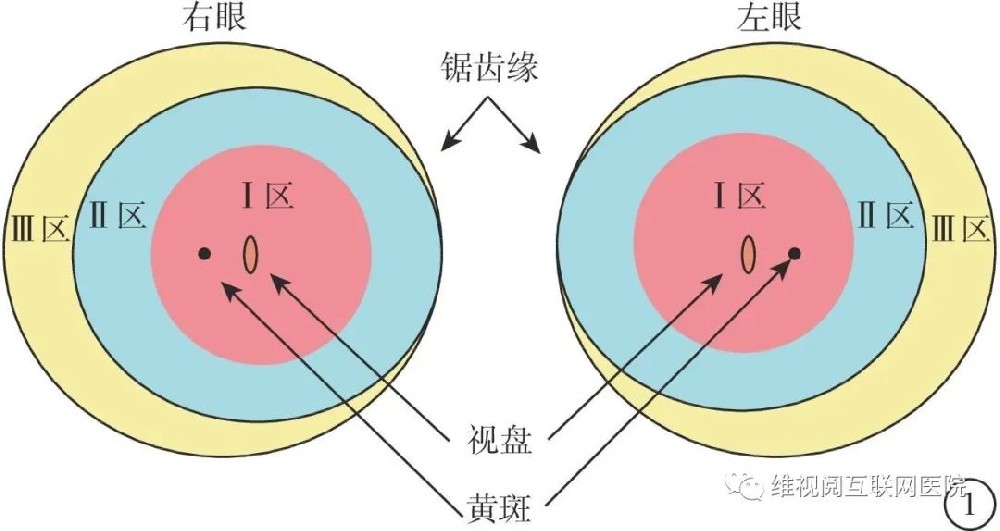
图1 早产儿视网膜病变分区示意图
分区的补充:(1)增加一个无血管区的舌形凹入切迹(notch)(图2),在黄斑区颞侧水平部约1~2个时钟位的无血管区向黄斑中心方向舌形状进入Ⅰ区,如果大部分病变在Ⅱ区,同时有“notch”病变进入 Ⅰ区,记录为“notch致ROPⅠ区病变”。(2)在Ⅱ区病变部位强调了“后Ⅱ区”(图3),即从黄斑颞侧Ⅰ区的边缘向周边2个视盘直径(DD),表明这个区域的病变相较于更周边的Ⅱ区更令人担忧。
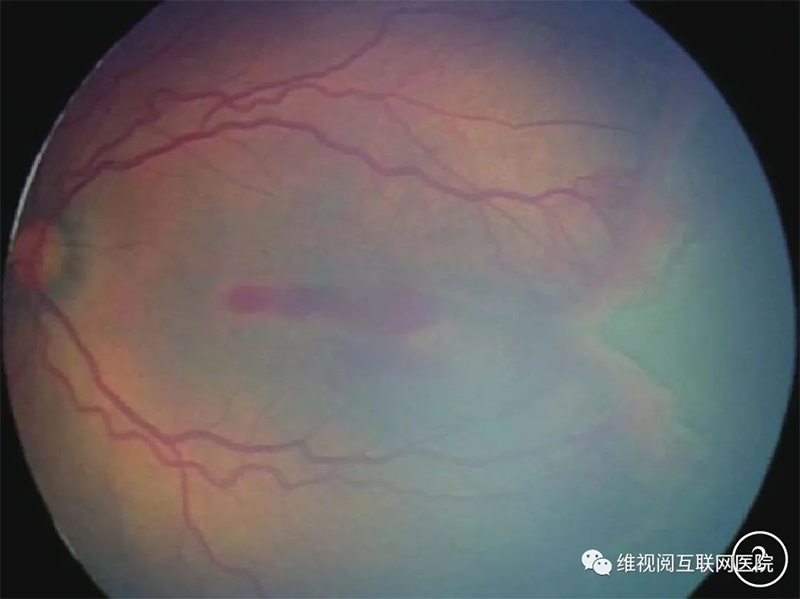
图2 切迹致早产儿视网膜病变Ⅰ区3期病变(北京大学人民医院眼科中心提供)
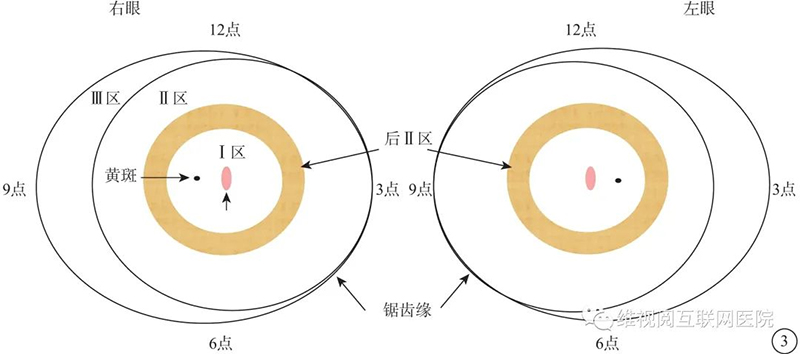
图3 早产儿视网膜病变左眼和右眼分区的边界示意图 病变范围按病变部位顺时钟标记;虚线示后Ⅱ区1.2
ROP分期和新的补充
1期:在眼底视网膜周边有血管区与无血管区之间出现分界线,色泽白,在视网膜平面内,白线后的周边血管可以轻微扩张和纡曲(图4A)。2期:眼底有血管区与无血管区的分界线隆起呈嵴样改变,色泽白到粉,嵴后可以有局限的视网膜表面新生血管芽,称为 “爆米花”,但尚未发展到3期(图4B)。3期:眼底分界线的嵴样病变上出现视网膜外新生血管增生,长入玻璃体内,可发生在Ⅰ区或Ⅱ区(图4C,4D),甚至看不到分界和嵴样改变也可诊断。4期:部分ROP病变从视网膜血管增生期进入纤维增生期,由此可发生部分视网膜脱离、黄斑异位和黄斑血管弓被拉直,这些改变源于周边视网膜纤维膜的牵引。纤维血管增生发生牵引性视网膜脱离先起源于周边,逐渐向后极部发展;此期根据黄斑区有无脱离分为4A期(无黄斑脱离)(图4E)和4B期(黄斑脱离)。急进型ROP(A-ROP)导致的视网膜脱离常呈“火山状”,表现为后极部视网膜脱离,而周边部视网膜在位。5期:全部视网膜脱离,病变晚期前房变浅或消失,可继发青光眼、角膜变性、眼球萎缩等。和前2版指南不同在于国际新分类细分为3种亚型。5A期:检眼镜检查可见视盘,开漏斗型视网膜脱离(open-open)(图5A);5B期:视盘不可见,晶状体后纤维血管增生或前开-后闭漏斗型视网膜脱离(open-closed)(图5B);5C期:为5B期伴有眼前节异常,如明显的前房变浅、虹膜-角膜-晶状体粘连、角膜混浊,提示闭漏斗型视网膜脱离(closed-closed)(图5C)。
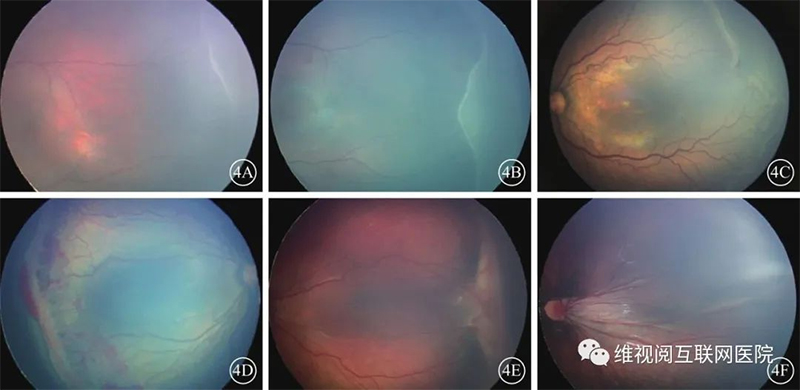
图4 早产儿视网膜病变分期示意图(图4A、4B、4F由空军军医大学西京医院提供;图4C由中山大学中山眼科中心提供;图4D、4E由北京大学人民医院提供)4A示1期;4B示2期;4C、4D示3期;4E示4A期;4F示4B期
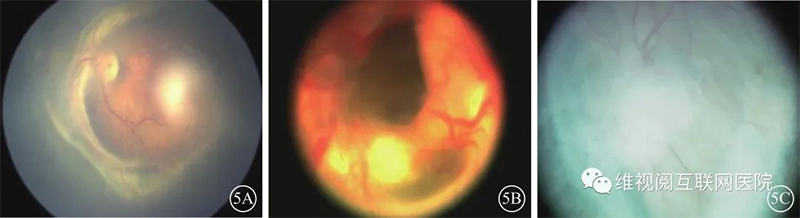
图5 早产儿视网膜病变5期示意图(图5A、5B由暨南大学深圳眼科医院提供;图5C由空军军医大学西京医院提供)5A示5A期;5B示5B期;5C示5C期分期的补充:(1)强调了前附加病变(preplus病变)的概念。附加病变(plus病变)在1982年定义为后极部(Ⅰ区内开始)的视网膜静脉扩张、动脉变形纡曲,甚至包括虹膜新生血管引起的瞳孔对光反射迟钝和玻璃体混浊,并使用了标准图像用于临床试验中的诊断[5]指导冷冻治疗。2005年《早产儿视网膜病变国际分类(第2版)》[6]中提出了preplus病变的概念,并将其定义为不正常的血管扩张和纡曲,但尚未达到plus病变的程度。2021年《早产儿视网膜病变国际分类(第3版)》[4]中确定plus病变从Ⅰ区开始,preplus病变的血管纡曲以动脉为主,静脉轻微扩张;plus病变的视网膜动脉纡曲和静脉扩张明显,病变可进入周边部,提示周边部已有扁平的新生血管形成,严重plus病变的视网膜动静脉均纡曲、扩张(图6)。Plus病变在病历书写中表达为“+”,如2期病变合并plus病变,书写为 “ROP 2期+”;2期病变合并preplus病变,书写为“ROP 2期前附加病(preplus)”。Plus病变和preplus病变都表示血管扩张和纡曲,只是程度不同。(2)将“急进型后极部ROP”(AP-ROP)修改为 “急进型ROP”。其描述发生在Ⅰ区和后极部Ⅱ区进展迅速、常累及4个象限的ROP类型,病变平坦,嵴可不明显,血管短路不仅发生于视网膜有血管区和无血管区交界处,也可发生于视网膜内(图7)。以往认为,AP-ROP发生在低体重早产儿,但实际也发生在稍大体重的早产儿,由于病灶常常超过后极部,所以做了新的更名。(3)增加了“视网膜周边尚未血管化” 的概念。视网膜血管从视盘向周边发育,早产儿出生后视网膜血管尚未发育到周边,出生越早,血管距周边越远,早产儿如果没有出现视网膜病变可记录为 “视网膜周边尚未血管化”或“未完全发育的视网膜血管进入Ⅱ区”。
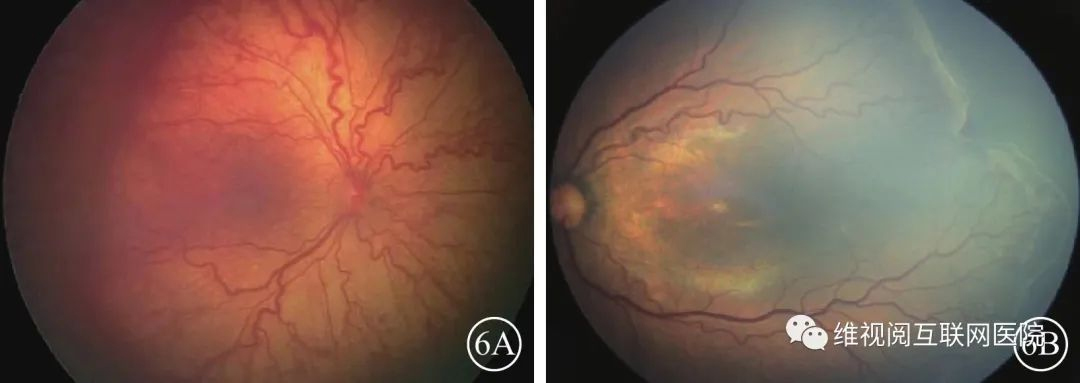
图6 早产儿视网膜病变(ROP)附加病变和前附加病变示意图 6A示ROP国际分类附加病变标准图;6B示Ⅱ区3期前附加病变(中山大学中山眼科中心提供)
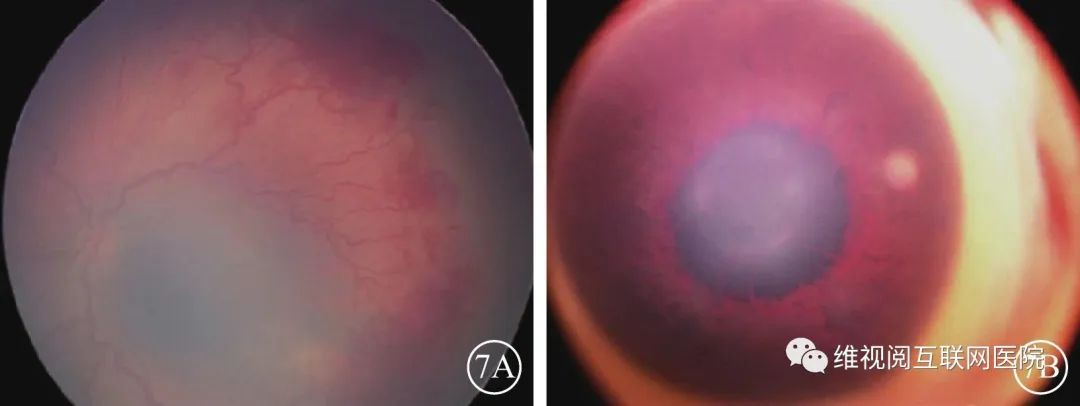
图7 急进型早产儿视网膜病变(A-ROP)示意图(北京大学人民医院提供)7A示A-ROP;7B示A-ROP合并虹膜新生血管
1.3
ROP病变范围标注
ROP病变范围标注:按病变部位所在的区和顺时钟标注病变范围(图3)。
1.4
ROP病变分型
1型:Ⅰ区的任何病变伴plus病变;Ⅰ区3期或3期伴plus病变;Ⅱ区2期伴plus病变、Ⅱ区3期伴plus病变。1型在ROP早期治疗(ETROP)研究中属于治疗适应证[7],且要求在24~48 h内接受治疗。2型:Ⅰ区的1期、2期病变;Ⅱ区3期病变。2型在ETROP研究中属于观察性病变[7]。
1.5
ROP退行、再活动和远期并发症
退行指病变退化和病灶消退(图8),可以是自行消退如血管扩张、纡曲的消退或者血管进一步向周边发育,也可以是经过治疗(如玻璃体腔注射抗VEGF药物治疗)后病变消退。消退可以是完全的或是不完全的,也可包括异常病变的持续存在,如周边部病变和血管被牵引,也可以是后极部的病变;玻璃体腔注射抗VEGF药物治疗ROP的病变退化过程不同于激光光凝治疗,视网膜血管扩张、纡曲的改善和新生血管的消退可发生在治疗后1~3 d,而激光光凝需要7~14 d。

图8 早产儿视网膜病变病灶消退示意图 (北京大学人民医院提供)
再活动指急性期特征的再出现。
远期并发症包括视网膜牵引,孔源性视网膜脱离(可同时合并或不合并ROP体征),可进展或不进展为视网膜脱离的黄斑劈裂(由3期退化形成的慢性牵引导致),远期视网膜变薄、裂孔、格子样变性等(由持续存在的未血管化视网膜导致),黄斑异常(中心凹无血管区异常、中心凹变平),视网膜血管改变(持续的血管变形、黄斑血管弓牵引变直合并“镰刀状”视网膜褶皱、异常分化的血管分支、血管弓末端的环形连接以及血管扩张和玻璃体积血),以及继发性闭角型青光眼。
1.6
ROP眼底病变评估
间接检眼镜仍然是最常用于ROP眼底评估的检查手段,除A-ROP外,ROP病变主要发生在Ⅱ区,建议在散瞳状态下进行眼底评估。儿童视网膜成像系统拍摄角度广,目前已越来越多地用于ROP筛查,需要注意我国人种的视网膜色泽常常会干扰眼底彩色图片上对视网膜新生血管的识别,使得细小的新生血管较难发现。对于眼底病变识别困难者推荐使用FFA和间接检眼镜。
PART 02抗VEGF药物治疗ROP适应证和随诊建议2.1
ROP治疗史
ROP治疗历程包括冷冻治疗(上世纪80年代末)、激光光凝(2003年推荐早期周边融合性激光光凝治疗[7-8])及抗VEGF药物治疗。冷冻治疗和激光光凝这两种凝固治疗均是通过破坏周边部视网膜无血管区,以达到视网膜新生血管退行的目的。50%的Ⅰ区病变在冷冻和激光光凝治疗后出现视野丧失和明显的早发近视[9-10]。ROP核心病变是新生血管形成,以及新生血管出血带来的不良解剖和视功能后果,抗VEGF药物的出现和临床实践证实了ROP急性期新生血管控制的有效性。
2.2
抗VEGF药物治疗的适应证
抗VEGF药物目前主要为贝伐单抗、雷珠单抗、阿柏西普、康柏西普,临床均证明以上药物均能够控制早期新生血管的生长。
贝伐单抗开启了抗VEGF药物对ROP的革命性治疗。2008年一项回顾性研究发现,贝伐单抗(0.625 mg/0.025 ml)可有效治疗ROPⅠ区和后极部 Ⅱ区3期伴plus病变,创伤小于冷冻和激光光凝治疗[11]。2011年The New England Journal of Medicine报道了贝伐单抗对比激光光凝治疗ROP 3期伴plus病变的前瞻性研究结果,肯定了贝伐单抗治疗Ⅰ区病变的有效性,但其针对Ⅱ区病变,治疗效果和激光光凝无差异[3]。尽管贝伐单抗开辟了在ROP 3期伴plus病变治疗中的应用,但其属于超适应证使用。
在中国,目前眼科常用的抗VEGF药物中主要是单抗类和融合蛋白类两类。雷珠单抗是一个重组的、人源化的与VEGF-A具有高度亲和性的单克隆抗体Fab片段。2019年一项随机、开放标签、平行对照优效研究应用雷珠单抗0.1 mg、0.2 mg和激光光凝对体重1500 g以下的ROP患儿(包括Ⅰ区1期伴plus病变、Ⅰ区2期伴plus病变、Ⅰ区3期、Ⅰ区3期伴plus病变、Ⅱ区3期伴plus病变、AP-ROP)进行治疗,观察期2年。结果显示,雷珠单抗0.2 mg优效于激光光凝[12],雷珠单抗0.1 mg、 0.2 mg和激光光凝3种方式2年观察期内的近视率(-5.00 D)分别为5%、8%、20%[13]。
康柏西普和阿柏西普均属于融合蛋白类,是一种VEGF受体与人免疫球蛋白Fc段基因重组的融合蛋白,竞争性抑制VEGF与受体结合并阻止VEGF家族受体的激活,从而抑制血管内皮细胞增生和血管新生。2017年,我国学者报告康柏西普0.25 mg治疗AP-ROP效果良好,且可以避免周边视网膜的结构破坏[14]。2018年Cheng等[15]证实,康柏西普(0.15 mg/0.015 ml)可有效治疗ROPⅡ区2期伴plus病变和3期伴plus病变。2022年,一项6个月的多中心随机对照研究证实,对比激光光凝治疗,阿柏西普0.4 mg可成功控制ROP的进展[16]。
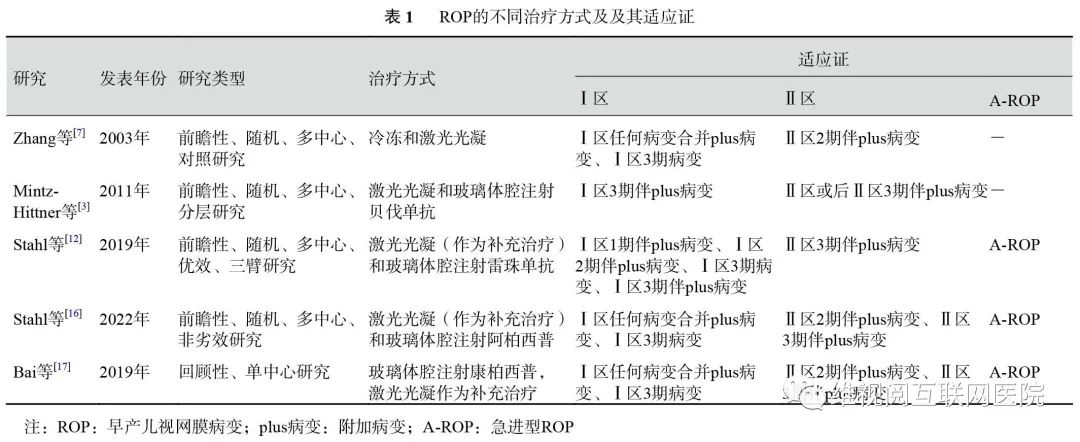
综上所述,ROP的抗VEGF药物治疗适应证主要针对ROPⅠ区和Ⅱ区病变的plus病变和preplus病变,特别是A-ROP、Ⅰ区任何病变以及ROP 3期病变即视网膜新生血管和虹膜新生血管[3, 12, 16-17](表1)。抗VEGF药物治疗适应证中的这些病变目前多以检眼镜下的观察为准,对于有条件行FFA检查者,建议可行FFA检查以早期准确地判断这些异常病变是否为视网膜新生血管。
2.3
抗VEGF药物治疗后的再治疗
首次注射后4周进行视网膜再评估,如果扩张、纡曲的血管已消退,可继续观察;如果在FFA下出现血管扩张伴血管渗漏,即“再活动”,应考虑抗VEGF药物的再治疗。FFA的强荧光易和纤维化组织的染色混淆,建议结合眼底检查,以区分纤维组织产生的假荧光。一般抗VEGF药物治疗次数不超过2次。在阿柏西普对比激光光凝的研究中,需要第二次注射的患儿仅占4.8%,且2次注射之间原则上不宜超过4周。抗VEGF药物治疗后视网膜血管发育到周边常常变得滞后,血管轻微扩张也会持续较长时间。一项关于ROP再治疗的荟萃分析纳入了30篇文献(4 686只眼),分析结果证明,对于1型ROP,激光光凝较雷珠单抗的再治疗率更低;对于Ⅰ区ROP,贝伐单抗较雷珠单抗再治疗率低。此外,康柏西普、阿柏西普和贝伐单抗的药物作用时间长于雷珠单抗[18-19]。
2.4
抗VEGF药物治疗的随诊建议
治疗后第1次随诊建议在治疗后1~3 d,目的是避免眼内炎的发生。第2次随诊建议在治疗后2周,可以和基线彩色眼底像进行对比,判断病变是否持续存在还是消退;第3次随诊建议在治疗后4周,再进行一次眼底评估。半年内建议每月随诊1次,对持续存在的无血管区可以继续随诊,随诊间隔可逐渐放宽3~12个月。
2.5
抗VEGF药物使用的注意事项
对于ROP 4期和5期病变,抗VEGF药物不是首选的治疗手段,原因是药物会加剧纤维组织的增生[20],导致视网膜脱离的形成和范围扩大。若对ROP 4期和5期病变行玻璃体切割手术,手术者在围手术期使用抗VEGF药物,可减少手术中及手术后出血的发生,但总体上不建议对ROP 4期和5期病变单独使用抗VEGF药物治疗。
如果使用贝伐单抗治疗ROP,应按照中华医学会眼科学分会眼底病学组2015年《我国视网膜病玻璃体腔注药术质量控制标准》[21]的要求,需避光并冷藏(2~8 ℃,不得冷冻)保存,存放和开启中都应当注意密闭和无菌,使用前观察冰箱温度记录,是否有停电或故障;药物一旦打开药瓶,剩余药液禁止回收再使用。
PART 03激光光凝治疗ROP适应证和随诊建议
Mintz-Hittner等[3]研究发现,对于ROPⅡ区病变,激光光凝与贝伐单抗治疗的有效性并无差异。Stahl等[12]研究发现,对于ROPⅠ区、Ⅱ区病变,雷珠单抗的疗效均优于激光光凝;同时,与雷珠单抗治疗后不利结构(视网膜脱离、黄斑牵引、黄斑皱褶和晶状体后混浊)发生率1.43%比较,激光光凝治疗后不利结构发生率达10.00%。Stahl等[16]研究发现,对于ROPⅠ区、Ⅱ区病变,激光光凝与阿柏西普的治疗成功率分别为82.1%、85.5%,两者并无明显差异。上述研究结果表明,激光光凝能够有效控制ROP 1~3期的活动性病变,特别是Ⅱ区病变。但由于激光光凝治疗后视网膜结构的不良事件发生率稍高、远期存在中高度近视的威胁,以及治疗时间长等问题,目前使用得越来越少。有些经抗VEGF药物治疗后局部不消退的新生血管或者玻璃体视网膜纤维增生加重时[20],仍可以选择局部的激光光凝治疗。选择新生血管存在的部位,对其远端无血管区增加局部激光光凝,可以通过间接检眼镜激光或者经巩膜激光进行。联合抗VEGF药物时不建议进行周边融合性激光光凝。
激光光凝治疗的随诊建议在病变控制后第1年可间隔3个月1次,以后可逐渐拉长随诊间隔时间。
PART 04ROP的长期随诊
ROP抗VEGF药物治疗的远期并发症少,只要早期及时治疗,病变逆转的概率大,单眼病变要提防弱视形成。建议每年1~2次视力和屈光筛查,及时发现弱视并及时治疗。条栅视力可尝试用于婴儿视力检测,能够自身对比视功能的发育。ROP 4期患儿还应随诊眼压,避免继发性闭角型青光眼导致的失明。ROP的后期随访包括条栅视力、验光以及弱视筛查,出现弱视时应及时进行弱视训练。




